Pengertian atom menurut teori atom Dalton adalah bagian terkecil dari suatu zat yang tidak dapat dibagi menjadi bagian yang lebih kecil. Saking kecilnya kita tidak memungkinkan untuk mengukur sebuah massa atom. Namun melalui percobaan dapat ditentukan massa satu atom relatif terhadap atom lainnya. Dibutuhkan satu jenis atom sebagai pembanding.

Sumber google image grafit
Massa Atom Relatif (Ar)
Massa atom relatif adalah massa suatu atom yang ditentukan dengan cara membandingkan dengan massa atom standar. Massa atom relatif, disingkat dengan Ar. Berdasarkan IUPAC (International Union of Pure and Applied Chemistry) yang digunakan sebagai standar penentuan massa atom relatif adalah atom karbon. Lambang atom tersebut adalah C. Atom tersebut memiliki jumlah proton sebanyak 6 dan memiliki massa sebesar 12 satuan massa atom bisa ditulis 12 sma atau 12 amu (atomic massa unit). Atom karbon-12 ini digunakan untuk standar sehingga satu satuan massa atom didevinisikan sebagai suatu massa yang besarnya tepat sama dengan seperdua belas massa satu atom C-12.
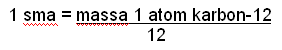
Kemudian didapatkan rumus penentuan massa atom relatif (Ar) adalah perbandingan massa rata-rata unsur dengan satu perdua belas massa 1 atom C-12.

Karena massa 1 atom C-12 adalah 1 sma atau 1 amu maka diperoleh rumus sbb:
![]()
Jika massa atom karbon dicari dalam tabel sistem periodik , nilainya bukanlah 12,00 sma tetapi 12,011 sma. Perbedaan ini terjadi karena adanya kelimpahan atom karbon yang memiliki isotop lebih dari satu. Perhatikan gambar di bawah ini.
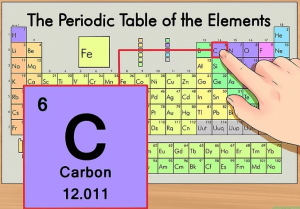
Sumber: wikihow.com
Hal tersebut di atas dapat dijelaskan bahwa karbon di alam ada dua isotop yaitu isotop karbon-12 dan isotop karbon-13. Kelimpahan dari karbon isotop C-12 adalah 98,90 % dan C-13 adalah 1,10 %. Massa atom karbon-13 adalah 13,00335 sma. Maka massa atom karbon rata-rata dapat dihitung sbb:
Ar C = (98,90% x 12,00000 sma) + (1,10% x 13,00335 sma)
= 11,868 sma + 0,143 sma
= 12,011 sma.
Jadi massa atom karbon 12,011 sma adalah nilai rata-rata massa atom C dari kedua isotop tersebut.
Contoh1
Massa 1 atom unsur X adalah 4.037 x 10-23 sedangkan massa 1 atom C-12 adalah 1.99268 x 10–23 gram. Berapakah massa atom relatif unsur X?
Jawab:

Maka Massa atom relatif unsur X adalah 24,311
Contoh 2
Unsur Cl di alam terdiri dari dua isotop dengan kelimpahan 75 % isotop Cl-35 dan 25% isotop Cl-37. Tentukan massa atom relatif unsur Cl
Jawab
Ar Cl = (% x Cl-35) +(% x Cl-37)
= (75% x 35 sma) + ( 25% x 37 sma)
= (0,75 x 35 sma) + ( 0,25 x 37 sma)
= 26,25 sma+9,25 sma
= 35,50 sma
Massa Molekul Relatif (Mr)
Massa molekul relatif adalah perbandingan antara massa rata-rata satu molekul terhadap 1/12 massa 1 atom C-12

Dalam satu molekul zat terdiri dari atom-atom penyusunnya. Misal satu molekul Ca(OH)2 terdapat 1 atom Ca, dua atom O dan dua atom H. Nilai Mr dapat dihitung dengan rumus sebagai berikut:
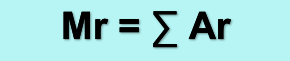
Sumber google image asam asetat
Contoh 1
Diketahui massa atom relatif C=12, H=1, O=16. hitiunglah massa molekul rata-rata senyawa CH3COOH
Jawab
Mr CH3COOH = 2 x Ar C + 4 x Ar H + 2 x Ar O
= 2 x 12 + 4 x 1 + 2 x 16
= 60

Sumber: google image kristal alumunium sulfat
Contoh 2
Diketahui massa atom relatif (Ar) O=16, Al =27 dan S=32. Hitunglah massa molekul relatif Al2(SO4)3.
Jawab
Mr Al2(SO4)3 = (2 x Ar Al) + (3 x Ar S) + (12 x Ar O)
= (2 x 27) + (3 x 32) + (12 x 16)
= 54 + 96 + 192
= 342
Sumber
Chang Raymond, 2004. Kimia Dasar Edisi Ketiga Konsep-Konsep Inti, Jakarta: Erlangga
Sudarmono Unggul, 2016. Kimia Untuk SMA/MA Kelas X Jakarta: Erlangga


